
近日,上海交通大学医学院附属仁济医院消化所许杰课题组在《自然》子刊(Nature Biomedical Engineering期刊)发表题为《抑制程序性死亡配体1(PD-L1)棕榈酰化促进T细胞的抗肿瘤免疫(Inhibiting PD-L1 palmitoylation enhances T-cell immune responses against tumours)》的研究论文。
论文报道了PD-L1的棕榈酰化修饰促进其表达的机制,通过设计的PD-PALM多肽降低了肿瘤细胞PD-L1的表达量,并开发了可竞争抑制PD-L1棕榈酰化的靶向多肽分子,为免疫检查点抑制剂开发提供了新思路,该靶向多肽分子经过优化有望成为肿瘤免疫治疗药物。
论文在线发表的同时,杂志配发了细胞生物领域资深专家Stephane Lefrancois教授的述评,详细地解释了这项工作的科学发现以及意义,认为“利用多肽抑制剂来阻断PD-L1棕榈酰化提示了基于翻译后修饰的新的靶向方法。许杰课题组开发的这种细胞穿透多肽显著抑制了PD-L1,因而可能有潜力成为治疗分子”。
免疫检查点(immune checkpoints)是分布于体内免疫系统中的抑制性信号通路,能够调控免疫反应的强弱和持续时间,避免组织损伤并维持机体自身的耐受。肿瘤能够利用免疫检查点通路的抑制作用,逃避免疫细胞的识别,特别是抑制T细胞的免疫应答,实现免疫逃逸。因此,抑制免疫检查点可以激发免疫系统原有的抗肿瘤能力。靶向免疫检查点蛋白CTLA-4、 PD-1/PD-L1的单克隆抗体已经被批准用于治疗多种类型的恶性肿瘤。
然而免疫检查点阻断疗法仍存在总体效率不高、长期使用后产生耐药以及可发生严重副作用等问题。PD-L1是PD-1的主要配体,一部分肿瘤依赖其表达的PD-L1结合T表面的PD-1并引起T细胞衰竭,促使肿瘤逃避宿主免疫系统的监视和杀伤作用。因此对PD-L1调控机制的深入研究将有助于改善治疗的效果。近年来的研究发现PD-L1不仅表达在细胞表面,还存在于细胞内的高尔基体、循环内体以及微囊泡上;细胞内的PD-L1有促癌功能,并可重新被转运到细胞表面。因此旨在彻底清除PD-L1的靶向蛋白质降解策略受到关注。许杰课题组近期发现了PD-L1的溶酶体降解机制,并在HIP1R蛋白调控模式的启发下设计了PD-LYSO用于靶向降解PD-L1(Nature Chemical Biology 2019)。
许杰课题组发现PD-L1蛋白质可被DHHC3酶进行棕榈酰化修饰,并减少其泛素化修饰和溶酶体降解。这种机制的阐明为PD-L1的抑制剂研发方法带来启示。由于目前棕榈酰化的小分子抑制剂缺少对DHHC酶的选择性,因此许杰课题组进行了棕榈酰化竞争性抑制剂的设计尝试。因为DHHC酶的特异性由底物序列决定,所以PD-L1的被修饰位点临近序列可能被DHHC3修饰,从而减少对内源性的PD-L1修饰。理论上这种竞争性多肽对其它DHHC成员的影响较小,因此可能其作用的选择性较2-BP更强。作者通过一系列实验证明上述竞争抑制剂的设计思路是切实有效的,并通过设计的PD-PALM多肽降低了肿瘤细胞PD-L1的表达量。在此基础上,今后还可以对PD-PALM进行衍生改造和修饰,以进一步提高其活性和稳定性,增强其成药潜力。
这一研究对PD-L1的棕榈酰化进行了较为深入的功能和机制探究,揭示了PD-L1棕榈酰化影响其溶酶体降解的确切途径,设计了以棕榈酰化为靶点的多肽型PD-L1抑制剂,为棕榈酰化相关的机制与转化研究带来启示。
该论文的通讯作者是许杰研究员,第一作者是姚晗博士,以及共同第一作者兰江博士研究生、李楚舒博士研究生和石虎兵教授,课题得到了国家重点研发计划和多项国家自然科学基金的资助。
 论文标题和作者信息
论文标题和作者信息
![]()
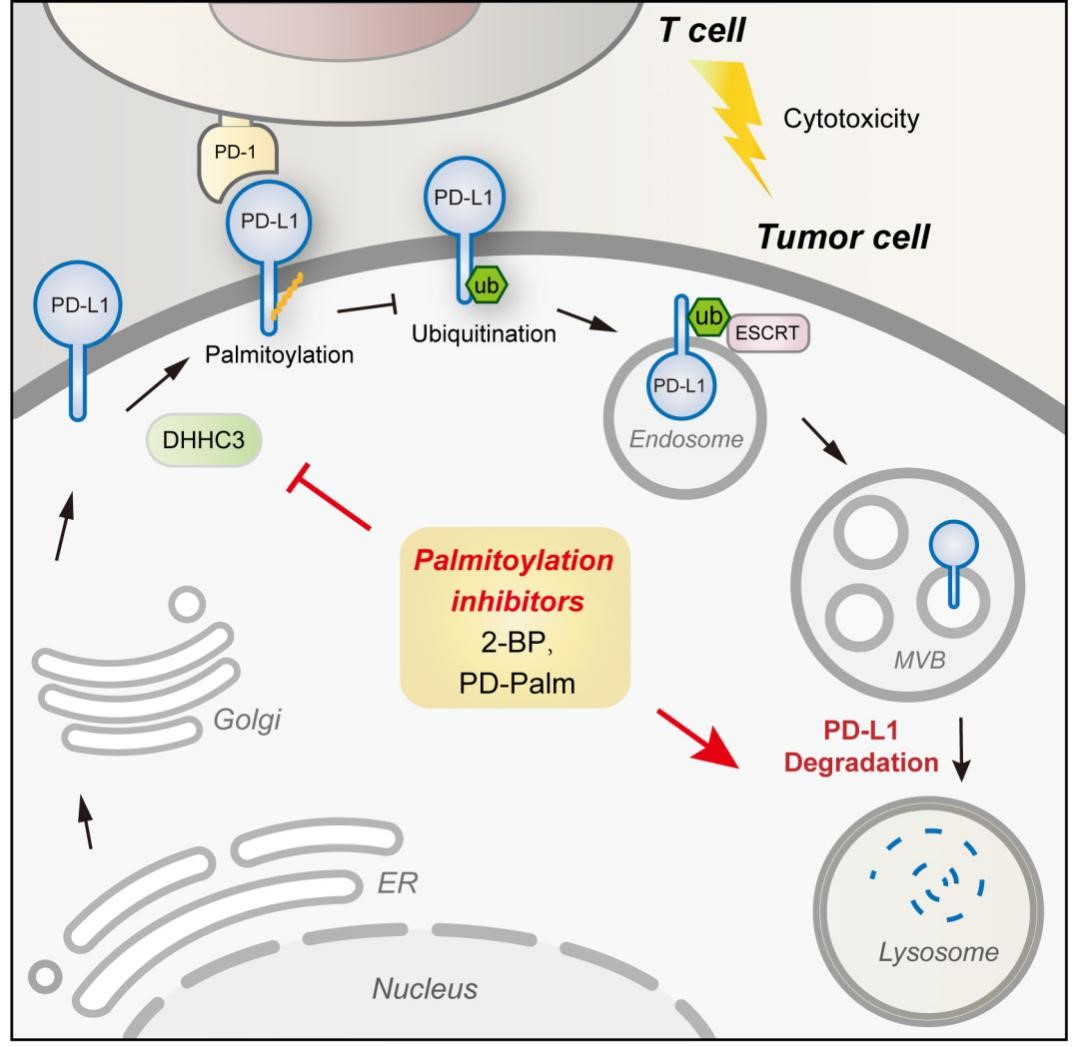
研究揭示的PD-L1棕榈酰化调控机制以及多肽抑制剂PD-PALM的作用方式
论文作者介绍:
许杰,上海交通大学医学院附属仁济医院研究员、博士生导师,博士毕业于比利时布鲁塞尔自由大学,主要从事消化系统肿瘤发生机制与生物治疗靶点的研究,在PD-1/PD-L1肿瘤免疫检查点和p53抑癌通路开展机制和转化研究工作。
论文链接:https://www.nature.com/articles/s41551-019-0375-6